
- 赖红昌教授
- 上海九院口腔种植科主任
- 口腔种植支持固定修复
- 口腔种植支持活动修复等
上海九院种植牙口腔颅颌面种植科主任,教授、主任医师、博士生导师。现任中华口腔医学会口腔种植专业委员会主任委员,国际口腔种植协会专家委员会委员...[详细]
研究成果
相关文章
同一个体中牙周及种植体周围组织在健康及炎症状态下的微生物群研究
更新时间:2019-06-27 14:36
同一个体中牙周及种植体周围组织在健康及炎症状态下的微生物群研究
Periodontal and peri-implant microbiota in patients withhealthy and inflamed periodontal and peri-implant tissues
姒蜜思 翻译;王刃 审校
关键字 : 病因,口腔种植,微生物群,种植体周围炎,牙周炎,牙周病学,定量聚合酶链反应,龈下/粘膜下菌斑
摘要
目的 : 比较同一个体中牙周及种植体周围组织在健康及炎症状态下6种牙周致病菌的检出率和检出量。
材料与方法 : 纳入22名中国籍患者。每位患者口腔内选取4个龈下/粘膜下位点用于收集微生物样本,该4个位点分别为 : (1)健康种植体周围组织位点 ; (2)种植体周围炎位点(PPD ≥5mm,探诊出血, X线显示种植体周围骨吸收); (3)健康牙龈组织位点 ; (4)牙周炎位点(PPD ≥ 4 mm)。用纸尖收集龈下/粘膜下菌斑,通过定量聚合酶链反应(q-PCR)对6种牙周可疑致病菌进行定量分析。这6种被定量分析的细菌包括 :牙龈卟啉单胞菌(P.g.)、牙密螺旋体(T.d.)、伴放线放线杆菌(A.a.)、具核梭杆菌(F.n.)、中间普氏菌(P.i.)和金黄葡萄球菌(S.a.)。统计分析前对微生物菌量的绝对值进行对数转换(log10)。
结果 : 检出频率最高的菌种为S.a.和F.n.,检出频率最低的菌种为A.a.和P.i.。炎症位点6种受检细菌的检出频率与健康位点相同或者更高,但是差异不具有统计学意义(P> 0.05, Cochran’s Q test)。 F.n.在牙周炎位点的菌量显著高于其他三类受检位点(P = 0.023, Friedman’s 2-way ANOVA)。其他受检细菌在四类位点的菌量没有统计学差异。在所有的牙周和种植体周围组织位点中,无论是健康还是炎症状态下都能检出S.a.。在4类被检位点中, S.a.的检出量的对数转换值大约为3.5(P = 0.232),为所有被检菌种中最高。
结论 : 在同一个体,牙周可疑致病菌在牙周和种植体周围组织的健康和炎症位点中都能被检出。 P.g.和F.n.的检出率和检出量和牙周炎显著相关,但与种植体周围炎不相关。 A.a.与牙周炎和种植体周围炎相关,但与健康牙周和种植体周围组织不相关。
种植修复是现代牙科修复的重要手段(Pjetursson & Lang 2008)。同时,种植治疗相关的生物学和机械并发症亦有被报道(Pjetursson et al.2007; Jung et al. 2008)。种植治疗生物学并发症,包括种植体周围粘膜炎及种植体周围炎,常见于种植牙功能修复的数年后(Mombelli et al.2012)。根据参考的诊断指标和风险因素的不同,种植体周围炎的10年发生率据报道为8.9%~43.3%(种植体水平)(Karoussis et al. 2004; Bragger et al. 2005, 2011; Fransson et al.2005; Ferreira et al. 2006; Roos-Jansaker et al. 2006; Renvert et al. 2007)。更值得注意的是,有牙周炎病史的患者罹患种植体周围炎的风险显著升高(Karoussis et al. 2004, 2007; Vander Weijden et al. 2005; Ferreira et al.2006; Schou et al. 2006; Quirynen etal. 2007; Heitz-Mayfield 2008; Renvert&Persson 2009)。
早期的研究已经表明,失败种植体周围的菌群和牙周病累及的患牙周围的菌群二者组成相类似,革兰氏阴性厌氧杆菌占据极高的比例(Rams & Link 1983;Rams et al. 1984; Mom- belli et al. 1987; Nakou et al.1987; Apse et al. 1989; Bower et al. 1989; Alcoforado etal. 1991; Leonhardt et al. 1993)。大量研究发现除了牙周可疑致病菌以外,在有溢脓和探诊出血位点的种植体周围深袋内金黄葡萄球菌(S.a.)有很高的检出量(Rams et al. 1990; Renvert et al. 2008),并且S.a.已被证明对钛表面有特异的附着性。
微生物研究发现天然牙的龈下菌斑存在向种植体周围迁移的迹象(Mombelli et al. 1995; Renvert et al.2008)。而且,健康状态下种植体周围的菌斑显著不同于失败的种植体或发生种植体周围炎的种植体的粘膜下菌斑(Mombelli et al. 1987; Leonhardt et al. 1999)。然而在大多数的前期研究中,健康和炎症状态下的种植体周围取样位点分别取自不同的个体(e.g., Leonhardt etal. 1999)。
因此,我们认为很有必要分析比较同一个体内在不同健康状态下,种植体周围和牙周组织内的菌斑样本。本研究旨在利用定量聚合酶链反应检测5种常见牙周可疑致病菌和金黄葡萄球菌在牙周及种植体周围菌群中的含量。零假设(null hypothesis)为6种被检细菌在健康和炎症状态的牙周和种植体周围组织内的含量相同。
材料与方法
伦理学声明
本研究通过了香港大学/港岛西区医联网的伦理委员会(HKU/HA HKW IRB; UW 12- 118)和上海交通大学医学院附属第九人民医院伦理委员会(2012-67)的审核。
研究主体
本研究根据以下纳入和排除标准筛选自2012年6月到2013年4月期间到上海交通大学医学院附属第九人民医院口腔颅颌面种植科就诊的患者。
纳入标准 :
(1)局部缺牙患者,接受过至少2颗种植牙治疗; (2)有牙周炎病史; (3)全身情况佳;
(4)愿意签署知情同意书。
排除标准 :
(1)全口牙列缺失患者 ; (2)患者近期服用对牙周状况有影响的药物(至少2周) ;
(3)需要使用预防性抗生素或类固醇药物的患者 ; (4)近期3个月内使用过系统性抗生素的患者。
牙周和种植体周围的组织检查由两位经过校准的牙医(ZLF;SMS)使用牙周探针(CPU 15 UNC; Hu-Friedy,Chicago, IL, USA)进行,记录的临床参数包括 : (1)菌斑指数(PlI)(Silness& Loe1964) ;改良菌斑指数(mPlI)(Mombelli et al. 1987)。 (2)牙 龈 指 数(GI)(Loe&Silness1963) ;改良出血指数(mBI)(Mombelli et al. 1987) ;探诊出血(BOP)(Lang et al. 1986; Gerber et al. 2009)。 (3)牙周探诊深度 Periodontal probing depth(PPD)(Glavind&Loe 1967)。 (4)炎症位点的根尖片。
基于以下标准对天然牙和种植体周围组织的健康状态进行分类 :种植体周围炎位点(DI)PPD≥5 mm,BOP阳性, X线显示骨吸收;牙周炎位点(DT)BOP阳性,PPD≥4 mm,此外, PPD≤3 mm的天然牙和种植牙定义为健康的天然牙(HT)和健康种植体(HI)。
对于每一位口腔内同时存在上述四类位点(牙周炎、健康牙周、种植体周围炎和健康种植体)的患者,我们会对该患者的四类位点对应的龈下/粘膜下菌斑进行微生物取样 : 1个种植体周围炎位点的样本(DI) ; 1个健康种植体位点的样本(HI) ; 1个健康牙周位点的样本(HT)和1个牙周炎位点的样本(DT)。
最终,我们一共对22位患者的88个位点的微生物样本进行了取样和分析。对于炎症位点,取样点选择炎症最重的位置 ;对于健康位点,去除炎症相邻的位点后进行随机选择。
取样方法
取样前,先用棉卷隔湿,用刮治器和消毒棉球去除龈上和粘膜上菌斑牙石。取样时,将3个消毒纸尖(25号)插入龈沟底或袋底10秒,随后将纸尖放入标记的消毒试管内。所有的样本冰冻储藏运送到香港进行分析。
DNA提取和定量定时PCR
我们使用QIAamp DNA Mini kits试剂盒(Qiagen,CA, USA)根据操作说明书对每个菌斑样本(n=88)进行提取细菌DNA。 6种被检细菌的标准菌株(T.d. 33520;P.g. 33277; A.a. 29523; F.n. 25586; P.i. 25611; and S.a.700698)的DNA从培养液中纯化,用DNA的浓度(NanoDrop 2000; NanoDrop Technologies, Inc., Wilmington, DE, USA)来确定细胞的数量,公式根据Novak等人(2008)的报道。然后将定量后的6种细菌DNA制备成10倍数的稀释溶液,细胞数从109到101。
临床DNA样本,以及10倍数稀释溶液一起置于96孔板,用StepOne-Plus Real-Time PCR系统进行定量分析 (Life technologies Inc., Grand Island, NY, USA)。 25µl的反应溶液包含2 µl的模板DNA, 12.5 µl Fast SYBRGreen Master Mix溶 液, 0.5 µl引 物 对(1 µM)和10µl的ddH2O。扩增循环的反应条件为 : 95°C 20秒, 40个循环95°C 3秒,设定细菌特异的退火和延伸温度30秒(表1)。引物的信息和退火温度见表1。 PCR产物的特异性通过分析熔解温度曲线确定。 6个受检菌种和总细菌的绝对值通过利用StepOne软件(Life technologies Inc.,Grand Island, NY, USA)构建标准曲线定量(范围为101到109细胞数)。利用以F.n. 菌株ATCC25586作为模板DNA的通用引物建立标准曲线,最终确定总细菌量。

数据分析
记录的数据包括研究主体的个人数据(包括性别、年龄、吸烟情况)和受检牙、种植体(包括种植体负载检查, PPD, BOP, mPlI/PlI, mBI和GI)的临床参数。对上述数据进行描述性统计。我们使用Wilcoxon秩和检验比较了DI和HI的种植负载时间,使用Friedman’s双向方差检验比较了4组位点(HI、 DI、 HT和DT)的mPlI/PlI、 mBI、 GI和PPD。 4组BOP的检验运用了Cochran’s Q检验。
细菌总数的绝对值通过StepOne软件(Life technologies, Inc, Grand Island, NY, USA)计算,统计分析前进行对数转换(log10)。未检测到细菌的临床样本使用数值1代替该样本的菌量。被检细菌的检出频数用103(Fraga et al. 2008)作为检测量阈值。由于105和106是棋盘DNA-DNA杂交法(checkerboard DNA–DNA hybridization)常用的阈值(Socransky et al. 1998),因此在本研究中也被作为阈值进行检出频数的分析。每种被检细菌占细菌总量的比率按细菌量的绝对数除以该样本的细菌总量计算。
统计学分析应用SPSS软件(version 18.0, SPSS Inc.,Chicago, IL, USA),显著性差异水平设定为α=0.05。
结果
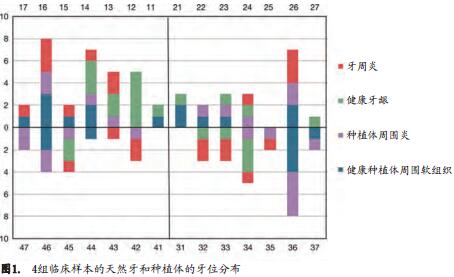
22名中国籍患者(12名女性, 10名男性)被收录作微生物样本取样的对象。年龄范围在21~80岁(平均年龄51.9岁), 2名吸烟者。每名患者从4个龈下/粘膜下组织位点内采取微生物样本,包括1个种植体周围炎位点(DI) ; 1个健康种植体位点(HI) ; 1个健康牙周位点(HT)和1个牙周炎位点(DT),总计88个样本。
图1显示了取样临床位点的分布图。图2显示了4类取样位点的临床检查参数。所有的种植体都为Straumann软组织水平SLA表面种植体(Straumann AG, Basel,Switzerland), DI组的种植体负载时间(4.9年)显著高于HI组(4.1年)(P=0.049)。 (改良)菌斑指数,牙龈指数,改良出血指数,探诊深度和探诊出血指数的均值在4组间有显著差异(P<0.001)。这些临床参数亦证实了4组被取样位点的不同临床健康状况。

健康和炎症状态下的牙周和种植体周围组织内的龈下/粘膜下菌斑中受检菌的检出率
表2列出了4组样本的被检细菌检出率(浓度阈值103)。 S.a.(n=62)和F.n.(n=59)的检出率最高, A.a.(n=6)和P.i.(n=2)的检出率最低。
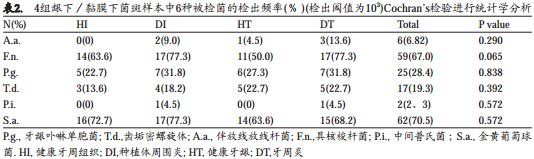
相比健康位点,所有6种被检菌在牙周炎或种植体周围炎位点内的检出率更高,但差异没有统计学意义(P> 0.05, Cochran’s Q test)。
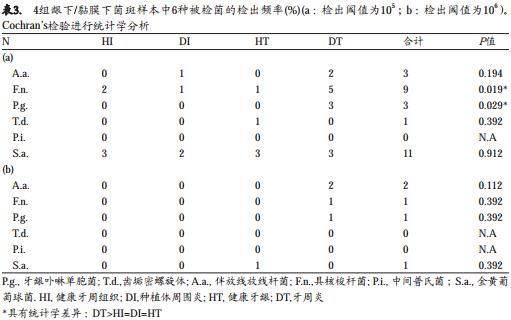
表3(a,b)分别列出了选用浓度阈值为105和106的细菌检出率。以105为阈值时, F.n.和P.g.在4组的检出率有显著差异。事后分析(Bonferroni检验)显示DT组的F.n.和P.g.的检出率显著高于其他三组(P< 0.001, McNemar’s检验)。
健康和炎症状态的牙周和种植体周的龈下/粘膜下菌斑的受检菌检出量(log10)
图3显示了每个个体的所有临床被检位点的被检细菌量的常用对数值(log10)。表4为HI、 DI、 HT和DT位点的6种被检细菌的检出量和总细菌检出量的比较。Friedman’s双向方差检验结果显示F.n.的检出量4组有显著性差异(P=0.023),其他细菌的检出量4组比较无统计学差异。事后分析发现DT组(3.95)的F.n.检出量显著高于HT组(2.93)(P<0.001, Wilcoxon signed-rank test,Bonferroni correction)。
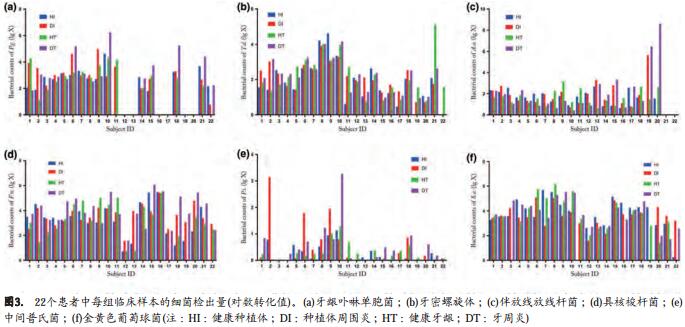
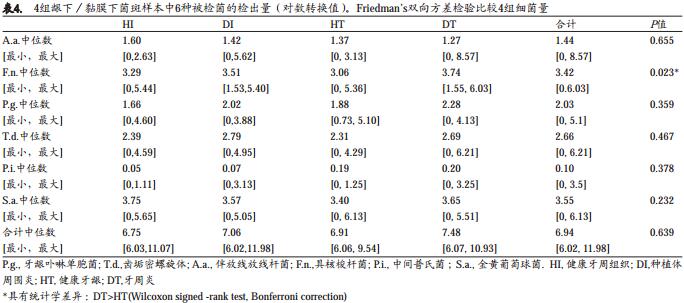
在牙周和种植体周围组织样本中,健康位点的总细菌检出量高于炎症位点,但是差异未达到统计学意义(P=0.639)。 4组的P.i.的log10检出量都低于0.50(P =0.378)。 P.i.、 T.d.和A.a.的log10检出量在4组都基本在2,并无显著性差异(P>0.05)。
牙周和种植体周围位点中,不论健康还是炎症的状态, S.a.都有很高的检出量。 S.a.的检出量的经对数变换后(log10)是6种被检细菌中最高的, 4组的检出量都在约3.5(P= 0.232)。
健康和炎症状态的牙周和种植体周围龈下/粘膜下菌斑的受检菌检出比例
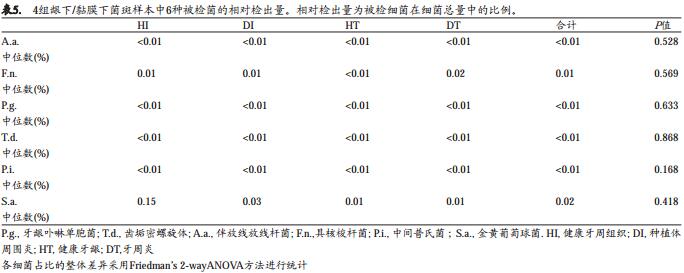
本研究进一步的比较了4组样本中6种受检细菌的检出比例。表5列出了龈下/粘膜下菌群中受检细菌的检出比例。 Friedman’s双向方差检验结果显示4组样本的6种被检细菌的检出比例无显著性差异(P>0.05)。总的来说,所有6种受检细菌在4组样本量中都只占细菌总量的很小部分。
讨论
本研究比较了同一个体中不同临床状态下的天然牙和种植体周围龈下/粘膜下菌斑。本横断面研究发现:天然牙和种植体周围的龈下/粘膜下菌斑构成明显不同,且与健康或炎症状态相关,然而这些差异未达到统计学意义。总体而言,在炎症位点6种被检细菌的检出量要高于健康位点。
Furst等(2007)的研究发现种植体植入30分钟后即可观察到细菌菌落形成。一个纵向研究表明植入6个月后种植体周围的P.g.、 A.a.和P.i.的阳性检出率接近天然牙水平(Leonhardt et al. 1993)。 Van Winkelhoff等(2000)和Heydenrijk等(2002)的研究进一步证明种植体植入后在没有牙周炎和种植体周围炎的情况下,种植体周围的菌群构成相对稳定,并且种植体周围若存在牙周致病菌也不一定会发展为种植体周围炎(Heydenrijk et al.2002)。同时,亦有研究表明种植体植入前的口腔内菌群会影响种植体周围菌群的构成,并且种植体周围牙周可疑致病菌的检出率在有牙周炎病史的患者中很高(Mombelli et al. 1995; Leonhardt et al. 1999)。然而,目前并不清楚可疑致病菌的含量在种植体周围炎发生后会如何改变。
因此,本研究的首要目的旨在比较同一个体龈下/粘膜下菌群中的主要牙周可疑致病菌的检出量。对所有患者的炎症和健康的种植体或天然牙位点进行配对分析比较。研究之所以设计将受检位点集中于同一个体,是为了符合同一个体对牙周炎和种植体周围炎致病性的宿主反应相同的假设。并且,在本横断面研究中,为了保证平行比较,在每个被检个体中种植体周围炎和牙周炎的位点都被取样分析,由于这类患者的数量较少,造成了本研究的样本量较小。本研究采用了Friedman’s双向方差分析来比较4组临床条件下的受检细菌量(log10转换值)。为了达到参数性方差分析的统计功效,在Friedman’s双向方差分析时需要参数性方差分析对应的样本量的1.31倍(Clark-Carter 2004)。已有研究报道牙周可疑致病菌包括A.a、 P.g和T.d在健康人群中的每样本检出量不超过104菌落形成单位(CFU),而在牙周炎群体中每样本中同类细菌的浓度都超过104菌落形成单位(CFU)(Stingu et al. 2012),统计学将此考虑为大效应量。当统计显著性水平为0.05时,大效应量(η2=0.138)的方差分析需要的样本量为18来达到80%的统计功效,因此对于Friedman’s方差检验来说,样本量22足够能够获得相同的统计功效。
在相同个体中,牙周和种植体周围健康和炎症位点的P.g.、 T.d.、 A.a.、 P.i和S.a.的检出量无差别。这一结果提示,该5种被检牙周可疑致病菌的检出量在健康位点与炎症位点相类似(牙周和种植周)。值得注意的是,种植体周围炎的进展与时间相关,也就是说现在定义为“健康”的位点亦存在后期发展为种植体周围炎的可能。要解决这一问题,亟需进一步的纵向研究以明确牙周炎患者的“健康”或“无症状”的种植体相比牙周健康个体的种植体,前者进展为种植体周围炎的风险是否更高。
在每个个体中,炎症位点的F.n.的检出量要显著高于健康位点。研究已经发现F.n.为天然牙生物膜的早期和晚期群集细菌的“桥梁”微生物(Bolstad et al. 1996)。据此观点,炎症位点的F.n.的高检出量能够反映整个菌落图谱结构的变化,即细菌生态从健康向疾病状态发展。这与Dabdoub等(2013)的研究结果一致,他们发现虽然健康和炎症种植体位点的“红色菌群”(red complex)检出量相类似,但是整个菌群的结构表现出显著的不同。
金黄葡萄球菌(S. a.)已经被证明与种植体周围感染尤其是种植体周围脓肿相关(Kronstrom et al. 2000;Leonhardt et al. 2003; Charalampakis et al. 2012; Persson& Ren- vert 2013)。在本研究中, S.a.在所有被检个体的牙周和种植体周样本中都有被检出。但是,之前的大部分研究中健康和炎症位点的取样自不同个体,这或许能够解释本次实验结果的不同。
本研究的第二个假设是检验不同的牙周和种植体周围样本(即HI, DI, HT和DT)的细菌检出频率是否相同。用Cochran’s Q检验比较4组受检细菌的检出率。显著性水平设置在0.05。 Myers等(1982)报道Cochran’sQ检验在协方差差异极大的情况下样本量在16以上即能获得一类错误(type I error )。
本研究的结果显示P.g.、 T.d.、 F.n.和S.a.在4组样本中都有检出。总体而言,炎症位点样本的细菌检出频率要高于健康位点样本,但是差异未达到统计学显著性。这与之前的研究结果相一致,牙周可疑致病菌在同一个体中的健康和炎症位点均能被检出(Leonhardt et al. 1993; Mombelli et al. 1995; Rutar et al. 2001;Takanashi et al. 2004; Tabanella et al. 2009; Dabdoub etal. 2013)。
q-PCR的菌量数据亦用105为检出阈值进行分析,因为105是在棋盘格DNA-DNA杂交技术常用的检出阈值(Socransky et al. 1998)。当运用105作为检出阈值时,P.i.和F.n.的检出频率在牙周炎位点(DT)显著高于其他3组临床情况。并且, P.g.仅在DT位点的检出量高于105。这与之前的研究结果相一致, P.g.在牙周病变位点的检出频率更高且检出量更大(Ashimoto et al. 1996)。同时,在种植体周围粘膜下位点,不论健康或炎症情况, P.g.的检出量都低于105的阈值。这一结果表明P.g.主要在牙周炎的发展中起重要作用,但在种植体周围炎的发展中不是主要致病菌。与之类似, F.n.与牙周炎进展显著相关,但与种植体周围炎的发展并不相关。 A.a.则相反,与牙周炎和种植体周围炎的发展都相关,但在健康的牙龈组织或粘膜组织中未检出。
在最近的一篇文献中, Dabdoub(2013)等用高通量测序的方法(pyrotag sequencing)比较了牙周和种植体周围微生物的样本。但是此研究仅对相邻的牙周和种植体周围的微生物成对取样,并没有像本研究中以4组分类进行取样。形成的临床情况组合有 :健康牙龈和种植体粘膜组织(HT和HI),牙周炎和种植体周围炎(DT和DI),健康牙龈和种植体周围炎(HT和DI)以及牙周炎和健康种植体粘膜(DT和HI)。高通量测序结果显示牙周和种植体周围的菌群显著不同,但是在天然牙和种植体周围菌群中均有检出一些牙周可疑致病菌。在这一点上,本研究的4组临床情况的比较结果和该研究的测序分析结果(Dabdoub et al. 2013)相一致。
综上所述,在同一个体健康和炎症状态下的牙周和种植体周围位点中都能检测到牙周可疑致病菌。然而即使被检细菌在所有临床状态下都能被检测到,某些菌种与疾病状态的关联情况却不尽相同。P.g.和F.n.的检出率和检出量与牙周炎显著相关,但与种植体周围炎不相关。 A.a.与牙周炎和种植体周围炎相关,但与健康牙周和种植体周围组织不相关。
致谢 : This study has been funded by the University of HongKong Departmental Supplementary Account for Implant Dentistry (Acct.104001529.022796.08007.301.01), Clinical ResearchFoundation (CRF) for the Promotion of Oral Health, Brienz, Switzerland, and National Basic Research Program of China (973 Program, contract grant number: 2012CB933604). The authors declareno conflict of interest.
参考文献
Alcoforado, G.A., Rams, T.E., Feik, D. & Slots, J. (1991) Microbial aspectsof failing osseointegrated dental implants in humans. Journal de Parodontologie 10: 11–18.
Apse, P., Ellen, R.P., Overall, C.M. & Zarb, G.A. (1989) Microbiota andcrevicular fluid collagenase activity in the osseointegrated dental implantsulcus: a comparison of sites in edentulous and partially edentulous patients. Journal of Periodontal Research 24: 96–105.
Ashimoto, A., Chen, C., Bakker, I. & Slots, J. (1996) Polymerase chain reaction detection of 8 putative periodontal pathogens in subgingival plaqueof gingivitis and advanced periodontitis lesions. Oral Microbiology andImmunology 11: 266–273.
Baumgartner, S., Imfeld, T., Schicht, O., Rath, C., Persson, R.E. & Persson,G.R. (2009) The impact of the stone age diet on gingival conditions in theabsence of oral hygiene. Journal of Periodontology 80: 759–768.
Bolstad, A.I., Jensen, H.B. & Bakken, V. (1996) Taxonomy, biology, andperiodontal aspects of fusobacterium nucleatum. Clinical MicrobiologyReviews 9: 55–71.
Bower, R.C., Radny, N.R., Wall, C.D. & Henry, P.J. (1989) Clinical andmicroscopic fndings in edentulous patients 3 years after incorporation ofosseointegrated implant-supported bridgework. Journal of Clinical Periodontology 16: 580–587.
Brägger, U., Hirt-Steiner, S., Schnell, N., Schmidlin, K., Salvi, G.E., Pjetursson, B., Matuliene, G., Zwahlen, M. & Lang, N.P. (2011) Complicationand failure rates of fxed dental prostheses in patients treated for periodontal disease. Clinical Oral Implants Research 22: 70–77.
Brägger, U., Karoussis, I., Persson, R., Pjetursson, B., Salvi, G. & Lang, N.P.(2005) Technical and biological complications/failures with single crownsand fxed partial dentures on implants: a 10-year prospective cohort study.Clinical Oral Implants Research 16: 326–334.
Brakstad, O.G., Aasbakk, K. & Maeland, J.A. (1992) Detection of Staphylococcus aureus by polymerase chain reaction amplifcation of the nuc gene.Journal of Clinical Microbiology 30: 1654–1660.
Charalampakis, G., Leonhardt, A., Rabe, P. & Dahlen, G. (2012) Clinical andmicrobiological characteristics of peri-implantitis cases: a retrospectivemulticentre study. Clinical Oral Implants Research 23: 1045–1054.
Clark-Carter, D. (2004) Quantitative Psychological Research: a Student’sHandbook, 2nd edn. London: Psychology Press, Taylor & Francis Group.Dabdoub, S.M., Tsigarida, A.A. & Kumar, P.S. (2013) Patient-specifc analysis of periodontal and peri-implant microbiomes. Journal of Dental Research 92: 168S–175S.
Ferreira, S.D., Silva, G.L., Cortelli, J.R., Costa, J.E. & Costa, F.O. (2006)Prevalence and risk variables for peri-implant disease in Brazilian subjects. Journal of Clinical Periodontology 33: 929–935.
Fraga, D., Meulia, T. & Fenster, S. (2008) Real-time PCR. In: Gallagher, S.R.& Wiley, E.A.,eds. Current Protocols Essential Laboratory Techniques. p.10.3.19. West Sussex, UK: John Wiley & Sons, Inc.
Fransson, C., Lekholm, U., Jemt, T. & Berglundh, T. (2005) Prevalence ofsubjects with progressive bone loss at implants. Clinical Oral ImplantsResearch 16: 440–446.
Fürst, M.M., Salvi, G.E., Lang, N.P. & Persson, G.R. (2007) Bacterial colonization immediately after installation on oral titanium implants. ClinicalOral Implants Research 18: 501–508.
Gerber, J.A., Tan, W.C., Balmer, T.E., Salvi, G.E. & Lang, N.P. (2009)Bleeding on probing and pocket probing depth in relation to probingpressure and mucosal health around oral implants. Clinical Oral ImplantsResearch 20: 75–78.
Glavind, L. & Löe, H. (1967) Errors in the clinical assessment of periodontaldestruction. Journal of Periodontal Research 2: 180–184.
Harris, L.G. & Richards, R.G. (2006) Staphylococci and implant surfaces: areview. Injury 37(Suppl 2): S3–S14.
Heitz-Mayfeld, L.J. (2008) Peri-implant diseases: diagnosis and risk indicators. Journal of Clinical Periodontology 35: 292–304.
Heydenrijk, K., Raghoebar, G.M., Meijer, H.J., van der Reijden, W.A., vanWinkelhoff, A.J. & Stegenga, B. (2002) Two-stage IMZ implants and ITI implants inserted in a single-stage procedure. A prospective comparativestudy. Clinical Oral Implants Research 13: 371–380.
Jung, R.E., Pjetursson, B.E., Glauser, R., Zembic, A., Zwahlen, M. & Lang,N.P. (2008) A systematic review of the 5-year survival and complicationrates of implant-supported single crowns. Clinical Oral Implants Research19: 119–130.
Karoussis, I.K., Kotsovilis, S. & Fourmousis, I. (2007) A comprehensiveand critical review of dental implant prognosis in periodontally compromised partially edentulous patients. Clinical Oral Implants Research 18:669–679.
Karoussis, I.K., Muller, S., Salvi, G.E., Heitz-Mayfeld, L.J.A., Brägger, U.& Lang, N.P. (2004) Association between periodontal and peri-implantconditions: a 10-year prospective study. Clinical Oral Implants Research15: 1–7.
Kato, H., Yoshida, A., Awano, S., Ansai, T. & Takehara, T. (2005) Quantitative detection of volatile sulfur compound-producing microorganisms inoral specimens using real-time PCR. Oral Diseases 11(Suppl 1): 67–71.
Kronström, M., Svensson, B., Erickson, E., Houston, L., Braham, P. & Persson, G.R. (2000) Humoral immunity host factors in subjects with failingor successful titanium dental implants. Journal of Clinical Periodontology27: 875–882.
Lang, N.P., Joss, A., Orsanic, T., Gusberti, F.A. & Siegrist, B.E. (1986)Bleeding on probing. A predictor for the progression of periodontal disease? Journal of Clinical Periodontology 13: 590–596.
Leonhardt, A., Adolfsson, B., Lekholm, U., Wikstrom, M. & Dahlen, G.(1993) A longitudinal microbiological study on osseointegrated titaniumimplants in partially edentulous patients. Clinical Oral Implants Research4: 113–120.
Leonhardt, A., Dahlen, G. & Renvert, S. (2003) Five-year clinical, microbiological, and radiological outcome following treatment of peri-implantitisin man. Journal of Periodontology 74: 1415–1422.
Leonhardt, A., Renvert, S. & Dahlen, G. (1999) Microbial fndings at failingimplants. Clinical Oral Implants Research 10: 339–345.
Löe, H. & Silness, J. (1963) Periodontal disease in pregnancy. I. Prevalenceand severity. Acta Odontologica Scandinavica 21: 533–551.
Maeda, H., Fujimoto, C., Haruki, Y., Maeda, T., Kokeguchi, S., Petelin, M.,Arai, H., Tanimoto, I., Nishimura, F. & Takashiba, S. (2003) Quantitativereal-time PCR using TaqMan and SYBR Green for Actinobacillus actinomycetemcomitans, Porphyromonas gingivalis, Prevotella intermedia, tetQgene and total bacteria. FEMS Immunology and Medical Microbiology 39:81–86.
Mombelli, A., Marxer, M., Gaberthüel, T., Grunder, U. & Lang, N.P. (1995)The microbiota of osseointegrated implants in patients with a history ofperiodontal disease. Journal of Clinical Periodontology 22: 124–130.
Mombelli, A., Muller, N. & Cionca, N. (2012) The epidemiology of peri-implantitis. Clinical Oral Implants Research 23(Suppl 6): 67–76.
Mombelli, A., van Oosten, M.A., Schurch, E., Jr & Land, N.P. (1987) Themicrobiota associated with successful or failing osseointegrated titaniumimplants. Oral Microbiology and Immunology 2: 145–151.
Myers, J.L., DiCecco, J.V., White, J.B. & Borden, V.M. (1982) Repeatedmeasurements of dichotomous variables: Q and F tests. PsychologicalBulletin 92(2): 517–525.
Nakou, M., Mikx, F.H.M., Oosterwaal, P.J.M. & Kruijsen, J.C.W.M. (1987)Early microbial colonization of permucosal implants in edentulous patients. Journal of Dental Research 66: 1654–1657.
Novak, M.J., Novak, K.F., Hodges, J.S., Kirakodu, S., Govindaswami, M.,Diangelis, A., Buchanan, W., Papapanou, P.N. & Michalowicz, B.S. (2008)
Periodontal bacterial profles in pregnant women: response to treatmentand associations with birth outcomes in the obstetrics and periodontaltherapy (OPT) study. Journal of Periodontology 79: 1870–1879.
Ozbek, A., Ozbek, S.M. & Ozbek, E. (2007) A comparison of sensitivities ofthe conventional and the real-time polymerase chain reaction methods fordetection of Treponema denticola in periapical abscesses. Saudi MedicalJournal 28: 1453–1455.
Persson, G.R. & Renvert, S. (2013) Cluster of bacteria associated withperi-implantitis. Clinical Implant Dentistry & Related Researchdoi:10.1111/cid.12052. [Epub ahead of print].
Pjetursson, B.E., Bragger, U., Lang, N.P. & Zwahlen, M. (2007) Comparisonof survival and complication rates of tooth-supported fxed dental prostheses (FDPs) and implant-supported FDPs and single crowns (SCs). ClinicalOral Implants Research 18: 97–113.
Pjetursson, B.E. & Lang, N.P. (2008) Prosthetic treatment planning on thebasis of scientifc evi dence. Journal of Oral Rehabilitation 35(Suppl 1):72–79.
Quirynen, M., Abarca, M., Van Assche, N., Nevins, M. & van Steenberghe,D. (2007) Impact of supportive periodontal therapy and implant surfaceroughness on implant outcome in patients with a history of periodontitis.Journal of Clinical Periodontology 34: 805–815.
Rams, T.E., Feik, D. & Slots, J. (1990) Staphylococci in human periodontaldiseases. Oral Microbiology and Immunology 5: 29–32.
Rams, T.E. & Link, C.C., Jr. (1983) Microbiology of failing dental implantsin humans: electron microscopic observations. The Journal of Oral Implantology 11: 93–100.
Rams, T.E., Roberts, T.W., Tatum, H. & Keyes, P.H. (1984) The subgingivalmicrobial-flora associated with human dental implants. Journal of Prosthetic Dentistry 51: 529–534.
Renvert, S., Lindahl, C., Renvert, H. & Persson, G.R. (2008) Clinical andmicrobiological analysis of subjects treated with Br”anemark or Astratechimplants: a 7-year follow-up study. Clinical Oral Implants Research 19:342–347.
Renvert, S. & Persson, G.R. (2009) Periodontitis as a potential risk factor forperi-implantitis. Journal of Clinical Periodontology 36: 9–14.
Renvert, S., Roos-Jansäker, A.M., Lindahl, C., Renvert, H. & Rutger Persson, G. (2007) Infection at titanium implants with or without a clinicaldiagnosis of inflammation. Clinical Oral Implants Research 18: 509–516.
Roos-Jans”aker, A.M., Lindahl, C., Renvert, H. & Renvert, S. (2006) Nineto fourteen-year followup of implant treatment. Part II: presence ofperi-implant lesions. Journal of Clinical Periodontology 33: 290–295.
Rutar, A., Lang, N.P., Buser, D., Burgin, W. & Mombelli, A. (2001) Retrospective assessment of clinical and microbiological factors affectingperiimplant tissue conditions. Clinical Oral Implants Research 12: 189–195.
Schou, S., Holmstrup, P., Worthington, H.V. & Esposito, M. (2006) Outcomeof implant therapy in patients with previous tooth loss due to periodontitis. Clinical Oral Implants Research 17: 104–123.
Sedgley, C.M., Nagel, A.C., Shelburne, C.E., Clewell, D.B., Appelbe, O. &Molander, A. (2005) Quantitative real-time PCR detection of oral Enterococcus faecalis in humans. Archives of Oral Biology 50: 575–583.
Silness, J. & Löe, H. (1964) Periodontal disease in pregnancy. II. Correlationbetween oral hygiene and periodontal condition. Acta Odontologica Scandinavica 22: 121–135.
Socransky, S.S., Haffajee, A.D., Cugini, M.A., Smith, C. & Kent, R.L., Jr.(1998) Microbial complexes in subgingival plaque. Journal of ClinicalPeriodontology 25: 134–144.
Stingu, C.S., Jentsch, H., Eick, S., Schaumann, R., Knofler, G. & Rodloff,A. (2012) Microbial profle of patients with periodontitis compared withhealthy subjects. Quintessence International 43: e23–e31.
Suzuki, N., Yoshida, A., Saito, T., Kawada, M. & Nakano, Y. (2004) Quantitative microbiological study of subgingival plaque by real-time PCRshows correlation between levels of Tannerella forsythensis and Fusobacterium spp. Journal of Clinical Microbiology 42: 2255–2257.
Tabanella, G., Nowzari, H. & Slots, J. (2009) Clinical and microbiologicaldeterminants of ailing dental implants. Clinical Implant Dentistry & Related Research 11: 24–36.
Takanashi, K., Kishi, M., Okuda, K. & Ishihara, K. (2004) Colonization byporphyromonas gingivalis and prevotella intermedia from teeth to osseointegrated implant regions. Bulletin of Tokyo Dental College 45: 77–85.
Van der Weijden, G.A., van Bemmel, K.M. & Renvert, S. (2005) Implanttherapy in partially edentulous, periodontally compromised patients: areview. Journal of Clinical Periodontology 32: 506–511.
Van Winkelhoff, A.J., Goene, R.J., Benschop, C. & Folmer, T. (2000) Earlycolonization of dental implants by putative periodontal pathogens in partially edentulous patients. Clinical Oral Implants Research 11: 511–520.



